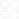
中学阶段常见元素化合价表(竞赛专用)ByLeiemVersion1注:本表不列出稀有气体、金属的0价及非常见价态等。元素常见化合价【主要离子】例子该化合价的性质元素及单质的其他性质氢H+1(主要)【H+】在大多数化合物中,如HCl、H2O、NaHCO3、NH3等●有三种同位素:1H、2H(或D)、3H(或T)●单质有还原性●可燃●密度最小的气体●无色无味-1【H-】在活泼金属氢化物中及其衍生物,如NaH、KH、CaH2、KBH4等有强还原性,可以和水反应放出H2锂Li+1【Li+】锂化合物如LiCl、LiOH、Li2O等焰色为深红色●银白色的活泼金属,可以和水反应●熔点比水高,密度很小●同位素6Li用在核反应堆内吸收中子●使用于电池内●在空气中燃烧生成Li2O●强还原剂钠Na+1【Na+】钠化合物如NaCl、Na2O2等焰色为黄色●银白色的活泼金属,可以和水反应,保存在煤油中●熔点比水低,密度、硬度小●和醇、酸反应放出氢气●在空气中燃烧生成Na2O2●强还原剂钾K+1【K+】钾化合物如KCl、KNO3等焰色为紫色(混有Na+时会为黄色,透过蓝色钴玻璃才能看到紫色)●银白色活泼金属,可以和水反应,比钠更剧烈,保存在煤油中●熔点比水低、密度、硬度小●强还原剂●在空气中燃烧生成K2O2和KO2●钾钠合金用作核反应堆的冷却剂铷Rb铯Cs+1【Rb+】【Cs+】铷、铯化合物如RbCl、CsCl等铷的焰色为浅紫色,铯的焰色为天蓝色●铷是银白色金属,铯是略带金黄色光泽的金属,熔点低,和水极其猛烈地反应●铯可以在空气中自燃●强还原剂镁Mg+2【Mg2+】镁化合物如MgCl2、MgSO4等●银白色活泼金属,和沸水略有反应●在空气中燃烧生成MgO,也有Mg3N2生成●能在CO2等大多数气体中燃烧●和酸剧烈反应●强还原剂●军事上用作照明弹钙Ca+2【Ca2+】钙化合物如CaCl2、CaSO4、CaO等焰色为砖红色●银白色活泼金属,和水反应●密度比水大●在空气中缓慢氧化或燃烧生成CaO●强还原剂锶Sr钡Ba+2【Sr2+】【Ba2+】锶、钡化合物如SrCl2、BaSO4等锶的焰色为深红色,钡的焰色为黄绿色;Ba2+有毒●银白色活泼金属,可以和水反应●密度比水大●强还原剂●可以在空气中燃烧硼B+3【BO33-】大多数硼化合物如H3BO3、B2O3等铝Al+3【Al3+】【AlO2-】(偏铝酸根)大多数铝化合物如Al2O3、NaAlO2等●银白色活泼金属,在空气中生成致密的氧化膜阻止进一步氧化●两性金属,可以和强酸、强碱反应●在浓硫酸、浓硝酸中钝化●高温下有强还原性,铝热反应的原料铊Tl+1【Tl+】亚铊化合物如TlCl等剧毒●较软的银白色金属,和酸反应生成亚铊化合物●剧毒+3【Tl3+】三价铊化合物如Tl2O3等剧毒;强氧化性镓Ga铟In+3【Ga3+、In3+】大多数镓、铟化合物中●镓的熔点低于体温碳C+2CO等有还原性●有多种同素异形体,如金刚石、石墨、C60等●高温下有还原性,可以还原金属氧化物、CO2等●可以在纯氧中燃烧发出耀眼白光●同位素14C用于考古+4【CO32-】【HCO3-】等CO2、CS2等其他金属碳化物中碳显负价(如CaC2等);有机物一般不讨论碳的化合价负价的碳化合物有还原性硅Si+4【SiO32-】硅酸盐如Na2SiO3、硅酸、SiF4、氟硅酸盐等●半导体材料●用作电脑芯片●可以和碱反应放出氢气+3SiHCl3-4【Si4-】某些硅化物如Mg2Si、Ca2Si等和水反应放出自燃性的硅烷锗Ge+4GeO2等●半导体材料锡Sn+4【Sn4+】四价锡化合物如SnO2、SnCl4等可溶于过量强碱●熔点较低,常用来制备合金,如青铜(传统的青铜是铜锡合金)、焊+2亚锡化合物如SnCl2、有还原性;溶【Sn2+】SnSO4等于过量强碱锡等铅Pb+4【Pb4+】四价铅化合物如Pb(CH3COO)4、PbO2等;Pb3O4含有+2和+4价的铅。有强氧化性●铅和酸反应生成二价铅化合物,四价铅则难达到●质软的金属●有毒●熔点较低,常用来制合金●可以防护放射线●在空气中生成致密的碱式碳酸铅氧化膜+2(主要)【Pb2+】二价铅化合物如PbO、PbCl2等氮N+5【NO3-】硝酸及硝酸盐(如KNO3)、N2O5等硝酸根离子酸化后具有强氧化性●无色无味的气体,不支持燃烧●化学性质稳定●高温或放电时和O2反应产生NO●和H2高温高压在有催化剂的条件下化合成NH3●游离态氮转化为化合态氮的过程叫做固氮●用作冷却、防腐、保护气体+4NO2、N2O4等易歧化+3【NO2-】亚硝酸及亚硝酸盐(如NaNO2)、N2O3等亚硝酸跟离子有致癌性+2NO等+1N2O等-3【NH4+】【N3-】氨气、铵盐(如NH4Cl)、氮化物(如Na3N、Mg3N2等)NH3溶于酸;铵盐和碱反应生成NH3;活泼金属氮化物和水反应放出NH3,生成碱其他【N3-】叠氮化物(如NaN3等)磷P+5(主要)【PO43-】【HPO42-】【H2PO4-】等磷酸及其盐(如H3PO4、HPO3、K3PO4、NaH2PO4等)、P4O10、PCl5、POCl3等无显著氧化性●有红磷、白磷(P4)、黑磷等多种同素异形体●易燃,在空气中燃烧生成P4O10●白磷易自燃,剧毒,可溶于CS2●白磷烧伤应用硫酸铜溶液处理●用过白磷的仪器应灼烧●红磷受热升华,白磷熔化●和氧化剂混合易爆+3【PO33-】等H3PO3、PCl3等+1次磷酸(H3PO2)及其盐有强还原性-3【P3-】磷化物(如K3P等)砷As+5【AsO43-】等砷酸及其盐、As2O5●有灰色类金属砷(灰砷)、黄砷、黑砷等多种同素异形体●可燃●大多数含砷化合物有剧毒●用作半导体+3【AsO33-】等亚砷酸及其盐、As2O3-3砷化物(如AsH3、K3As等)活泼金属砷化物和水反应产生H3As其他As4S4等锑Sb+5【SbO3-】【SbF6-】等SbF5、HSbF6、SbCl5、锑酸盐等SbF5或锑和氟构成的阴离子有极强的酸性●熔点低,有多种同素异形体,但只有灰锑最稳定●用作合金、半导体●有毒+3【Sb3+】Sb2O3、SbCl3等-3【Sb3-】锑化物等和水反应铋Bi+5【BiO3-】BiF5、NaBiO3等强氧化性●低熔点●常用来制作合金●燃烧有蓝色火焰+3【Bi3+】Bi(NO3)3、Bi2O3等最常见价态氧O-2【O2-】【OH-】【……】氧化物如SO2、CuO、I2O5等;氢氧化物如KOH等;大多数含氧酸及其盐如HClO4、BaSO4等;……最常见的价态●无色无味的气体,供给呼吸,助燃●最常见的同素异形体是臭氧(O3),有鱼腥臭味和很强的氧化性(常温下能将银、硫化铅等物质氧化),易被催化分解,受热易分解●在氧气中高压放电能产生臭氧●液氧为淡蓝色液体,固态为淡蓝色雪花状固体●绝大多数元素都存在氧的化合物●接近100%的纯氧能使人的呼吸停止-1【O22-】过氧化物如H2O2、Na2O2等和水反应放出氧气+2OF2等有极强氧化性;受热分解+0.5【O2+】二氧基盐(如O2F2、O2PtF6、O2AsF6)等其他【O2-】【O3-】等超氧化物(如KO2)、臭氧化物(如CsO3)、HOF(此处0价)等强氧化性;超氧化物、臭氧化物和水反应放出氧气硫S+6【SO42-】【S2O82-】【S2O72-】等SO3、H2SO4、硫酸盐、过硫酸盐、焦硫酸盐、SF6等●黄色固体,可燃,在空气中燃烧产生淡蓝色火焰,在纯氧中则为蓝紫色火焰●熔点低●和碱金属反应爆炸,研磨即可反应●能和一些不活泼金属如Cu、Hg反应●溶于二硫化碳或碱金属硫化物溶液中●硫的分子式为S8●硫有多种同分异构体●硫、碳、硝酸钾用一定的工艺混合可以制成黑火药+4【SO32-】等SO2、亚硫酸盐等+2SCl2等-2【S2-】硫化物(如K2S、H2S、Cu2S、HgS等)、硫取代氧的化合物等活泼金属硫化物和酸反应产生H2S;某些金属的硫化物则很稳定;还原性其他【Sn2-】等多硫化物(Na2S3、Na2S5等)、S2Cl2等硒Se+6【SeO42-】SeO3、硒酸盐等强氧化剂;浓、热的硒酸能溶解金●灰色或红色固体,熔点低,受热易挥发,有多种同素异形体●在空气中燃烧有蓝色火焰+4【SeO32-】SeO2、亚硒酸盐等有毒-2【Se2-】硒化物等和酸反应产生H2Se碲Te+6【TeO42-】等TeO3、碲酸盐等●熔点低的银灰色或深灰色固体●在空气中燃烧产生蓝色火焰●太阳能薄膜电池的主要原料●有毒●和硒一样,摄入非微量的化合物会让+4【TeO32-】TeO2、亚碲酸盐等+2【TeX42-】二卤化碲、四卤碲酸盐等-2【Te2-】碲化物等和酸反应产生H2Te其他【Ten2+】【Te64+】等Te8(WCl6)2、Te6(AsF6)4等n=4~8,颜色随离子而异人体散发恶臭氟F-1【F-】【HF2-】【SiF62-】等氟化物(如CaF2、HF、NH4F、NH4HF2、KHF2、UF6、XeF6等)、氟代含氧酸盐、含氟有机物等可溶性氟化物有毒,直接接触可引起严重灼伤●极毒的淡黄绿色气体,有芥末气味,化学性质极其活泼●无正价●只有少数元素不能和氟直接化合●用于制造含氟高分子材料、制造农药、制造人造血液、分离铀的同位素氯Cl+7【ClO4-】高氯酸、高氯酸盐、Cl2O7等强氧化剂●剧毒的黄绿色气体,有刺激性气味,化学性质十分活泼●化合价多、氧化物不稳定●有漂白性●易液化●可溶于水●用于有机合成,是重要的化工原料+5【ClO3-】氯酸、氯酸盐等强氧化剂+4ClO2等+3【ClO2-】亚氯酸、亚氯酸盐等+2ClO·+1【ClO-】次氯酸、次氯酸盐、Cl2O等强氧化剂-1【Cl-】等氯化物等溴Br+7、+5、+4、+3、+1、-1见“氯Cl”(溴、碘+1价有BrX、IX等)溴酸盐有强氧化性●有毒的深红棕色重质液体,易挥发,有刺激性气味,化学性质活泼●溶于水、乙醇、四氯化碳、苯等●用于消毒碘I+7、+5、+3、+1、-1见“氯Cl”(次碘酸及其盐常温不存在)碘化物有较强的还原性●深紫色固体,有毒,易升华,有刺激性气味●受热升华●用于消毒●溶于水、碘化物溶液、乙醇、四氯化碳、苯等其他【I3-】等碘溶于碘化物溶液中产生:I2+I-=I3-使淀粉变蓝;有较强的还原性钛Ti+4【Ti4+】【TiO32-】钛酸盐、TiO2、四价钛化合物●银白色金属,有很强的抗腐蚀能力,常温下化学性质稳定●高温下能在氧气、氮气中燃烧,分别生成TiO2和TiN●制作合金、用作添加剂及颜料(TiO2)+3【Ti3+】三价钛化合物+2【Ti2+】二价钛化合物和水或酸反应放出氢气钒V+5【VO3-】【VO43-】钒酸盐、偏钒酸盐、V2O5、VF5、VOCl3等●银灰色金属,耐腐蚀●用作催化剂●有丰富的价态,各价态有不同的颜色+4【VO2+】VCl4、VO2等+3【V3+】V2O3、VBr3等+2【V2+】VO、VCl2等铬Cr+6【CrO42-】【Cr2O72-】(此价态常CrO3、CrO5、铬酸盐(BaCrO4、K2CrO4、Na2CrO4等)、铬酸跟在酸性条件下转化为重铬酸●银白色金属,十分坚硬●有丰富的价态,化合物颜色多样●用于制见)重(chóng)铬酸盐(K2Cr2O7、(NH4)2Cr2O7等)根,碱性条件下逆转换。氧化剂。致癌。备强度大的合金,或用于金属防锈●在硝酸中钝化+5【Cr(O2)43-】K3Cr(O2)4红褐色+4CrO2、K2CrF6等+3【Cr3+】【CrO2-】(此价态常见)铬盐(如CrCl3等)、Cr2O3、NH4Cr(SO4)2、次铬酸盐等主要为绿色+2【Cr2+】亚铬盐(如CrCl2等)、CrO等。Cr2+和水反应放出H2钨W+6(常见)【WO42-】等钨酸盐、仲钨酸盐(H2W12O4210-)、磷钨酸盐、WCl6、WO3等●可以在纯氧中燃烧发出白光●熔点很高的钢灰色至银白色金属●质地坚硬、紧密●用于灯丝、合金等+4WO2、WS2等锰Mn+7【MnO4-】高锰酸及其盐(如KMnO4等)、Mn2O7有强氧化性,不稳定。紫色