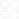
弱电解质的电离一、选择题1.下列说法下列正确的是()A、强电解质的水溶液中不存在溶质分子,弱电解质的水溶液中存在溶质分子和离子B、强电解质的水溶液导电性强于弱电解质的水溶液C、强电解质都是离子化合物,弱电解质都是共价化合物D、强电解质易溶于水,弱电解质难溶于水2.已知HClO是比H2CO3还弱的酸,氯水中存在下列平衡:Cl2+H2OHCl+HClO,HClOH++ClO—,达平衡后,要使HClO浓度增加,可加入()A、H2SB、CaCO3C、HClD、NaOH3.将浓度为0.1mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是()A.c(H+)B.)(HFKaC.)()(HcFcD.)()(HFcHc4.一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是()A.a、b、c三点溶液的pH:cbaB.a、b、c三点醋酸的电离程度:abcC.用湿润的pH试纸测量a处溶液的pH,测量结果偏大D.a、b、c三点溶液用1mol/LNaOH溶液中和,消耗NaOH溶液体积:cab5.下列电离方程式中正确的是()A、NaHCO3溶于水:NaHCO3=Na++H++CO32—B、NaHSO4溶于水:NaHSO4=Na++H++24SOC、HF溶于少量水中:HF=H++F-D、(NH4)2SO4溶于水:(NH4)2SO42NH4++24SO6.下列事实一定能说明HNO2是弱电解质的是()①常温下NaNO2溶液的PH大于7②用HNO2溶液做导电实验灯泡很暗③HNO2和NaCl不能发生反应④0.1mol/LHNO2溶液的PH=2.1A、①③B、②③C、①④D、②④7.已知:(1)PH=2的次碘酸(HIO)溶液与PH=12的NaOH溶液等体积混合,所得溶液呈酸性;(2)0.01mol/L的HIO3或HMnO4溶液与PH=12的Ba(OH)2溶液等体积混合所得溶液均呈中性。则下列有关结论不正确的是()A、HIO是强酸B、HIO3是强酸C、HMnO4是强电解质D、HIO是弱酸导电能力加水体积Oabc8.下列说法正确的是()A.纯水的pH值一定等于7B.[H+]大于10-7mol/L的溶液一定是酸性溶液C.pH=2的溶液中[H+]是pH=1的溶液的两倍D.[H+]=2×10-7mol/L的溶液可能是中性溶液9.下列叙述中,正确的是()A.中和10ml0.1mol·L-1醋酸与中和100ml0.01mol·L-1醋酸所需同种碱溶液的量不同B.体积相等、pH相等盐酸和硫酸溶液中,H+离子的物质的量不相等C.等体积pH=3的酸溶液与pH=11的碱溶液相混合后,混合溶液的pH一定等于7D.250C时,将0.1mol·L-1NaOH溶液与pH=1的稀硫酸等体积混合,混合后溶液pH=710.下列关于等体积、等pH的NaOH溶液和氨水的说法正确的是()A.两种溶液中OH—浓度相同B.需要等浓度、等体积的盐酸中和C.温度升高10℃,两溶液的pH仍相等D.两种溶液中溶质的物质的量浓度相同11.25℃时有浓度为1mol/L的五种溶液:①HCl②H2SO4③CH3COOH④NH4Cl⑤NaOH,由水电离出的c(H+)大小关系正确的是()A.④③①=⑤②B.①=②③④⑤C.②①③④⑤D.④③①⑤②12.25℃时用PH均为10的氨水和NaOH溶液,分别中和等体积的pH=2的盐酸,当盐酸恰好被中和时,消耗的氨水和NaOH溶液的体积分别是V1和V2,则V1和V2关系正确的是()A.V1=V2B.V1<V2C.V1>V2D.V1≤V213.pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其溶液的pH与溶液体积(V)的关系如右图所示,则下列说法正确的是()A.A、B两酸溶液物质的量浓度一定相等AB.稀释后A酸溶液的酸性比B酸溶液强BC.若a=5,则A是弱酸,B是强酸D.若A、B都是弱酸,则2<a<514.某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如右上图所示。据图判断正确的是()A.ll为盐酸稀释的pH值变化曲线B.b点溶液的导电性比c点溶液的导电性强C.a点KW的数值比c点KW的数值大D.b点酸的总浓度大于a点酸的总浓度15.常温下,将pH=5的硫酸溶液稀释500倍,稀释后溶液中c(SO42-)与c(H+)的比值约为()A.1:1B.1:2C.1:10D.10:116.高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:()0apH211000V/mL酸HClO4H2SO4HClHNO3Ka1.6×10-56.3×10-91.6×10-94.2×10-10从以上表格中判断以下说法中不.正确的是()A.在冰醋酸中这四种酸都没有完全电离B.在冰醋酸中高氯酸是这四种酸中最强的酸C.在冰醋酸中硫酸的电离方程式为H2SO4===2H++SO2-4D.水对这四种酸的强弱没有区分能力,但醋酸可以区分这四种酸的强弱17.室温时,将xmLpH=a的稀NaOH溶液与ymLpH=b的稀盐酸充分反应。下列关于反应后溶液pH的判断,正确的是()A.若x=y,且a+b=14,则pH7B.若10x=y,且a+b=13,则pH=7C.若ax=by,且a+b=13,则pH=7D.若x=10y,且a+b=14,则pH718.室温下向10mLpH=3的醋酸溶液中加入水稀释后,下列说法正确的是()A.溶液中导电粒子的数目减少B.溶液中)()()(33OHcCOOHCHcCOOCHc不变C.醋酸的电离程度增大,c(H+)亦增大D.再加入10mlpH=11的NaOH溶液,混合液pH=719.向CH3COOHCH3COO-+H+的平衡体系中,加入下列物质能使醋酸的电离程度和溶液的pH都变小的是()A.H2OB.CH3COONaC.NH3·H2OD.H2SO420.若pH=3的酸溶液和pH=11的碱溶液等体积混合后溶液呈酸性,其原因可能()A.生成一种强酸弱碱盐B.弱酸溶液和强碱溶液C.弱酸与弱碱溶液反应D.一元强酸溶液与一元强碱溶液反应123456789101112131415161718192021.一定温度下,有a.盐酸、b.硫酸、c.醋酸三种酸(用a、b、c来回答)。(1)当其物质的量浓度相同时,[H+]由大到小的顺序是。(2)同体积、同物质的量浓度的三种酸溶液,中和NaOH的能力由大到小的顺序是(3)当[H+]相同时,物质的量浓度由大到小的顺序为__________。(4)当[H+]相同、体积相同时,分别加入足量锌,相同状况下产生的气体体积由大到小的顺序(5)当[H+]相同、体积相同时,同时加入形状、密度、质量完全相同的锌。若产生相同体积的氢气(相同状况),则开始时反应速率的大小关系是,反应所需时间的长短关系是___。(6)将[H+]相同的三种酸溶液均加水稀释至体积为原来的10倍后,[H+]由大到小的顺序为(7)当其物质的量浓度相同时,体积相同时,同时加入形状、密度、质量完全相同的足量的锌。则开始时反应速率的大小关系是_____,产生气体体积由大到小的顺序为。22.常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3HCO3-+H+的平衡常数K1=。(已知:10-5.60=2.5×10-6)23.(1)甲、乙两瓶氨水的浓度分别为1mol·L-1和0.1mol·L-1,则甲、乙两瓶氨水中[OH-]之比_____小于___(填“大于”、“等于”或“小于”)10。请说明理由(2)常温下,pH=10的NH3·H2O溶液稀释10倍体积。①[NH3·H2O]原[NH3·H2O]后_____10(用“、或=”号填写)。②[OH-]原[OH-]后_______10(用“、或=”号填写)。③pH值范围是________。24.25℃时欲配制1L某溶液,使水电离产生的[H+]=10-13mol·L-1。(1)若向水中加入5.0mol·L-1的盐酸能达到要求,则加入盐酸的体积是多少?(2)若向水中加入NaOH晶体能达到要求,则加入NaOH的质量是多少?25.(10分)25℃时,在0.5L0.2mol/L的HA溶液中,有0.01mol的HA电离成离子。求该温度下的电离常数和电离度。答案123456789101112131415161718192021、(1)bac(2)ba=c(3)cab(4)ca=b(5)a=b=c_,a=bc(6)ca=b(7)bac,ba=c22、5、4.17×10—7mol/L23、(1)设甲、乙两瓶氨水的电离转化率(电离度)分别为α1和α2,则有[OH-]甲[OH-]乙=1mol·L-1·α10.1mol·L-1·α2=10α1α2,由于α1α2,所以[OH-]甲[OH-]乙10___。(2)__9pH10____24、答案:(1)0.02L(2)4g25、答案:2.22×10-3mol·L-110%