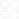
第三节化学平衡的移动化学平衡常数【高考新动向】考点梳理(三年17考)1.理解化学平衡常数的含义,能够利用化学平衡常数进行简单的计算。2.了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。【考纲全景透析】一、化学平衡常数1.化学平衡常数(1)定义:在一定温度下,达到平衡的可逆反应,其平衡常数用生成物平衡浓度(气体平衡分压)的方次之积与反应物平衡浓度(气体平衡分压)的方次之积的比值来表示,这时的平衡常数称为浓度平衡常数(压强平衡常数)(2)表达式用Kc(Kp)表示。对:aA(g)+bB(g)cC(g)+dD(g),badccBADCK)()()()(BpApDpCpKbadcp(3)影响因素:平衡常数K与温度有关,与浓度和压强无关。(4)平衡常数的意义:①K的大小,可推断反应进行的程度。K越大,表示反应进行的程度越大,反应物的转化率越大;K越小,表示反应进行的程度越小,反应物的转化率越小②平衡常数表达式表明在一定温度条件下达成平衡的条件。在某温度下,某时刻反应是否达平衡,可用该时刻产物的浓度商Qc与Kc比较大小来判断。当Qckc,υ(正)υ(逆),未达平衡,反应逆向进行;当Qckc,υ(正)υ(逆),未达平衡,反应正向进行;当Qc=kc,υ(正)=υ(逆),达到平衡,平衡不移动。③平衡常数数值的大小,只能大致告诉我们一个可逆反应的正向反应所进行的最大程度,并不能预示反应达到平衡所需要的时间。如2SO2(g)+O22SO3(g)298K时Kp=3.6×1024很大,但由于速度太慢,常温时,几乎不发生反应。二、化学反应进行的方向。1.自发过程含义:在一定条件下,不需要借助外力作用就能自发进行的过程。2、化学反应方向进行的判据(1)焓判据放热过程中体系能量降低,△H<0,具有自发进行的倾向,但有些吸热反应也可以自发进行,故只用焓变判断反应的方向不全面。(2)熵判据①熵:量度体系混乱(或有序)的程度的物理量,符号S(同一物质,三种状态下熵值:气态>液态>固态)②熵增原理:在与外界隔离的体系中,自发过程将导致体系的熵增大。即熵变(△S)大于零。③熵判据体系的混乱度增大(既熵增),△S>0,反应有自发进行的倾向,但有些熵减反应也可以自发进行,故只用熵变判断反应的方向也不全面。(3)复合判据——自由能判据①符号:△G,单位:kJ·mol-1②公式:△G=△H—T△S③应用:△G<0能自发进行△G=0平衡状态△G>0不能自发进行具体的的几种情况:焓变(△H)熵变(△S)反应的自发性<0>0任何温度都能自发进行<0<0较低温度下能自发进行>0>0高温下能自发进行>0<0任何温度都不能自发进行注:过程的自发性只能用于判断反应进行的方向,不能确定过程是否一定会发生和过程发生的速率。【热点难点全析】〖考点一〗化学平衡常数应用1.应用(1)判断、比较可逆反应进行程度的大小。K值越大,反应进行的程度越大;K值越小,反应进行的程度越小。(2)判断可逆反应是否达到化学平衡状态对于可逆反应aA(g)+bcC(g)+dD(g),在一定温度下的任意时刻,反应物与生成物浓度有如下关系:浓度商Q=cccdcacbQK反应向正反应方向进行,v正v逆=K反应处于化学平衡状态,v正=v逆K反应向逆反应方向进行,v正v逆(3)判断可逆反应的反应热若升高温度,K值增大,则正反应为吸热反应;若升高温度,K值减小,则正反应为放热反应。(4)计算反应物或生成物的平衡浓度及反应物的转化率。2.相关计算(1)步骤①写出有关化学平衡的方程式。②确定各物质的起始浓度、转化浓度、平衡浓度。③根据已知条件建立等式关系进行解答。(2)模式如mA(g)+npC(g)+qD(g),令A、B起始物质的量浓度分别为amol/L、bmol/L,达到平衡后消耗A的物质的量浓度mxmol/L。mA(g)+npC(g)+qD(g)起始(mol/L)ab00变化(mol/L)mxnxpxqx平衡(mol/L)a-mxb-nxpxqxK=pxpqxqa-mxmb-nxn。(3)说明①反应物:c平=c始-c变;生成物:c平=c始+c变。②各物质的转化浓度之比等于化学方程式中化学计量数之比。③转化率=反应物转化的物质的量浓度反应物起始的物质的量浓度×100%。【另】平衡常数的其他应用(1)利用化学平衡常数可以判断反应进行的程度。一般K105时认为该反应基本进行完全;K10-5一般认为该反应难以进行;而K在10-5~105之间的反应被认为是典型的可逆反应。(2)利用平衡常数可以判断达到平衡后的瞬间改变体系内各物质的物质的量和容器的体积而造成的平衡移动的方向。如某温度下,在一容积可变的容器中,反应2A(g)+B(g)2C(g)达到平衡时,A、B、C的物质的量分别为4mol、2mol、4mol。保持温度和压强不变,对平衡混合物中三者的物质的量作均减半或均加倍处理,平衡移动方向的判断可以利用等效平衡的知识,还可以利用K与Qc的关系来判断。设未改变前容器的体积为V,则此时K()/()224VV242VV。若都减半,瞬间容器的体积减半,设此时的体积为V1,V1=V/2,此时Qc()()2112112VV21VV,因为V1=V/2,所以Qc=K,平衡不发生移动。同理可得都加倍时,平衡也不移动。【典例1】关于化学平衡常数K的叙述正确的是()A.K越大,表示化学反应速率越大B.对任一可逆反应,温度升高,则K值增大C.对任一可逆反应,K越大,表示反应物的转化率越大D.加入催化剂或增大反应物的浓度时,K值就增大【解析】选C。K值大,反应速率不一定大,对于放热反应,温度越低K值越大,反应速率越小,A错;对于正反应为放热反应的可逆反应,升高温度,K值减小,B错;K值越大,表示反应正向进行的程度越大,反应物的转化率越大,C对;催化剂及反应物的浓度对平衡常数没有影响,D错。〖考点二〗化学平衡的计算1.解题步骤(1)写出涉及到的可逆反应方程式。(2)找出起始量、转化量和平衡量中哪些是已知量,哪些是未知量,按三段式列出。(3)根据问题建立相应的关系式进行计算。2.模式(三段式)令A、B起始物质的量浓度分别为amol/L、bmol/L,达到平衡后消耗A的物质的量浓度为mxmol/L。mA(g)+nB(g)pC(g)+qD(g)起始量ab00转化量mxnxpxqx平衡量a-mxb-nxpxqx(1)求平衡常数()()()()Kpqmnpxqxamxbnx(2)求转化率100某反应物转化的量转化率%某反应物起始的量(3)①对于反应物:n(平)=n(始)-n(变)对于生成物:n(平)=n(始)+n(变)②各物质的转化量之比等于化学方程式中化学计量数之比。【提醒】(1)采用“三段式”解题时,要注意单位问题,可以先在起始、变化和平衡后面标出单位,也可以在计算过程中每个数值的后面书写单位,但是不能漏掉单位。(2)计算转化率时,根据题目已知信息,只要转化量和起始量物理量相同即可,不一定要使用转化浓度除以起始浓度计算。【典例2】某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应:3A(g)++2D(g),反应一段时间后达到平衡,测得生成1.6molC,则下列说法正确的是()A.该反应的化学平衡常数表达式是K=c4c2c3c2B.此时,B的平衡转化率是40%C.增大该体系的压强,平衡向右移动,化学平衡常数增大D.增加B,平衡向右移动,B的平衡转化率增大[解析]化学平衡常数的表达式中不能出现固体或纯液体,而物质C是固体,A错误;根据化学方程式可知,平衡时减少的B的物质的量是1.6mol×0.5=0.8mol,所以B的转化率为40%,B正确;增大压强时平衡右移,但平衡常数不变,平衡常数只与温度有关,C错误;增加B后平衡右移,A的转化率增大,而B的转化率减小,D错误。[答案]B【高考零距离】【2012高考】1、(2012·江苏高考·10)下列有关说法正确的是A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0B.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈C.N2(g)+3H2(g)2NH3(g)△H<0,其他条件不变时升高温度,反应速率V(H2)和氢气的平衡转化率均增大D.水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应【参考答案】B【分析】本题是化学反应与热效应、电化学等的简单综合题,着力考查学生对熵变、焓变,水解反应、原电池电解池、化学反应速率的影响因素等方面的能力。A.分解反应一般是常识吸热反应,熵变、焓变都大于零,仅在高温下自发。内容来源于《选修四》P34-P36中化学方向的判断。B.铁比铜活泼,组成的原电池中铁为负极,更易被氧化。C.据平衡移动原理,升高温度平衡向逆反应方向移动,平衡转化率减小。D.水的离子积常数Kw随着温度的升高而增大,说明水的电离是吸热反应,越热越电离,水的离子积常数Kw随着温度的升高而增大。【解题指南】解答本题时应注意深刻理解有关原理,利用相关原理分析具体问题。【解析】选B。选项具体分析结论A不能自发进行说明该反应△G=△H-T△S不小于零,该反应△S0,△H0错误B铁比铜活泼,镀层受损后,形成原电池铁作负极,更易腐蚀正确C合成氨为放热反应,升高温度,反应速率加快,氢气转化率变小(平衡逆向移动)错误D水的离子积随温度升高增大,说明水电离吸热错误2、(2012·江苏高考·4)某反应的反应过程中能量变化如右图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能)。下列有关叙述正确的是A.该反应为放热反应B.催化剂能改变反应的焓变C.催化剂能降低反应的活化能D.逆反应的活化能大于正反应的活化能【参考答案】C【分析】本题属于化学反应与能量的考查范畴,虽然《2012年江苏考试说明》中没有提及“活化能”这一概念,但《选修四》课本第3页的绪言中就有这些内容,新课程标准中也有“活化能”这一概念。看来高三复习一定注意要抓课本、抓基础,抓《考试说明》的同时,适当兼顾新课程标准,不能急功近利、顾此失彼。【解题指南】解答本题时应注意搞清化学反应的热效应与反应物和生成物能量的大小关系、催化剂对化学反应的影响、活化能的概念。【解析】选C。A项,该反应生成物能量比反应物高,该反应为吸热反应,A项错误;B项,焓变是反应的热效应,催化剂不能改变反应的热效应,B项错误;C项,对照图中有无催化剂的两种情况,有催化剂活化能较低,催化剂能降低反应的活化能,C项正确;D项,E1大于E2,正反应的活化能大,D项错误。3、(2012·福建高考·23)(14分)23.(1)元素M的离子与NH4+所含电子数和质子数均相同,则M的原子结构示意图为。(2)硫酸铝溶液与过量氨水反应的离子方程式为。(3)能证明Na2SO3溶液中存在SO32—+H2OHSO3—+OH—水解平衡..的事实是(填序号)。A.滴入酚酞溶液变红,再加入H2SO4溶液红色退去B.滴入酚酞溶液变红,再加入氯水后红色退去C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色退去(4)元素X、Y在周期表中位于同一主族,化合物Cu2X和Cu2Y可发生如下转化(其中D是纤维素水解的最终产物):aOH22uNDCuXCY过量浓硝酸一定量的溶液澄清溶液悬浊液①非金属XY(填“>”或“<”)②Cu2Y与过量浓硝酸反应有红棕色气体生成,化学方程式为。(5)在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g)2C(g)+D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高,简述该反应的平衡常数与温度的变化关系:。物质ABCD起始投料/mol2120【解题指南】解答本题时应明确如下几点:(1)砖红色沉淀是Cu2O。(2)要证明某溶液中存在水解平衡,要证明两点:一要证明存在某种水解产物,二要证明水解平衡会发生移动。(3)温度变化引起的平衡正向移动,平衡常数变大,反之变小。【解析】(1)铵根离子中含有10个电子,11