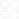
族IAIIAⅢBⅣBⅤBⅥBⅦBⅠBⅡBⅢAⅣAⅤAⅥAⅦA0周期表中纵列数第1列第2列第3列第4列第5列第6列第7列第8列第9列第10列第11列第12列第13列第14列第15列第16列第17列第18列第一周期(1-2号)原子序数元素符号名称1H氢2He氦2种元素电子排布式1s11s2电子排布图原子结构示意图第二周期(3-10号)原子序数元素符号名称3Li锂4Be铍5B硼6C碳7N氮8O氧9F氟10Ne氖8种元素电子排布式1s22s11s22s21s22s22p11s22s22p21s22s22p31s22s22p41s22s22p51s22s22p6电子排布图原子结构示意图第三周期(11-18号)原子序数元素符号名称11Na钠12Mg镁13Al铝14Si硅15P磷16S硫17Cl氯18Ar氩8种元素电子排布式1s22s22p63s11s22s22p63s21s22s22p63s23p11s22s22p63s23p21s22s22p63s23p31s22s22p63s23p41s22s22p63s23p51s22s22p63s23p6电子排布图原子结构示意图第四周期18种(19-36号)原子序数元素符号名称19K钾20Ca钙21Sc钪22Ti钛23V钒24Cr铬25Mn锰26Fe铁27Co钴28Ni镍29Cu铜30Zn锌31Ga镓32Ge锗33As砷34Se硒35Br溴36Kr氪电子排布式【Ar】4s11s22s22p63s23p64s21s22s22p63s23p63d14s2【Ar】3d24s21s22s22p63s23p63d34s21s22s22p63s23p63d54s1【Ar】3d24s21s22s22p63s23p63d64s2【Ar】3d74s21s22s22p63s23p63d84s21s22s22p63s23p63d104s11s22s22p63s23p63d104s21s22s22p63s23p63d104s24p11s22s22p63s23p63d104s24p2【Ar】3d104s24p31s22s22p63s23p63d104s24p4【Ar】3d104s24p5【Ar】3d104s24p6第五周期18种37-54号价电子排布式4s14s23d14s23d24s23d34s23d54s13d54s23d64s23d74s23d84s23d104s13d104s24s24p14s24p24s24p34s24p44s24p54s24p6第六周期32种55-86号镧系电子排布图价电子排布图第七周期?种满32种87-满118号锕系原子结构示意图共价键分类s-sσ键s-pσ键p-pσ键p-pΠ键分子或离子CO2SO2CO32-CH4NH4+中心原子杂化轨道类型spsp2sp3a64+2=65-1=4x234H2ONH3b221sp3sp3中心原子上的孤对电子数0100分子或离子的价层电子对数2334VSEPR模型名称直线形平面三角形平面三角形正四面体形正四面体形分子或离子的立体构型名称直线形V形平面三角形正四面体形正四面体形形成配合物的条件:①配位体有孤电子对;②中心原子有空轨道。法二:价层电子对数=(中心原子价层电子数+配原子数×n+电荷数)/2说明:配原子为H,X-F,Cl,Br,In=1;配原子为O,Sn=0;配原子为Nn=-1。电荷数:带正电减带负电加。配合物形成:颜色改变、溶解度改变无机含氧酸分子酸性1、对于同一种元素的含氧酸来说,该元素的化合价越高,其含氧酸的酸性越强。2、含氧酸的通式可写成(HO)mROn,R相同,n值越大,酸性越强。注意:碳酸因溶解度较小,酸性弱。1-36号元素电子排布式、电子排布图、原子结构示意图比较·分子结构与性质学习参考开远一中高三化学备课组周艳芳编拟Ⅷ电子云和原子轨道:(1)电子运动的特点:①质量极小②运动空间极小③极高速运动。电子运动只能用统计的观点来描述它在原子核外各处出现的概率——电子云。常把电子出现的概率约为90%的空间圈出来,人们把这种电子云轮廓图成为原子轨道。S的原子轨道是球形的(右下图),能层序数越大,原子轨道的半径越大。nsnp(n≥2)nd(n≥3)nf(n≥4)P的原子轨道(右下图)是哑铃状(或纺锤形)的,每个P能级有3个轨道,互相垂直,分别以Px、Py、Pz为符号。P原子轨道的平均半径也随能层序数增大而增大。能层序数n越大,原子轨道的半径越大。这是由于1s,2s,3s……电子的能量依次增高,电子在离核更远的区域出现的概率逐渐增大,电子云越来越向更大的空间扩展。分子结构与性质杂化轨道类型sp3spsp2中心原子上的孤对电子数=1/2(a-xb)a为中心原子的价电子数;x为与中心原子结合的原子数;用价层电子对互斥模型判断下列分子或离子的构型VSEPR模型杂化轨道数=中心原子孤对电子对数+中心原子结合的原子数b为与中心原子结合的原子最多能接受的电子数氢为1,其它原子=8-该原子的价电子数。ABX型价层电子对互斥理论对几种分子或离子的立体构型推测族行周期元素种类分子或离子的立体构型+11+321+11281+192881+422+523+624+725+826+927+1028+22+17287+16286+15285+14284+13283+12282+202882+212892+18288+3628188+2228102+2328112+2428131+2528132+2628142+2728152+2828162+2928181+3028182+3128183+3228184+3328185+3428186+3528187轴对称镜面对称